水を0℃以下で冷却すると氷になるが、周りの環境によっては水が0℃になっても氷にならず、水のまま温度が下がり続ける現象がみられる。このように水が本来固体になるべき温度でも液体で存在している状態を「過冷却」という。
あらかじめ冷凍庫で冷やした容器に過冷却状態の純水を注入する様子を次の動画に示す。このときの水の温度は約0℃と-2℃である。 |
[動画1]
純水を容器に注入すると、0℃では水のままであるのに対して、-2℃ではシャーベット状の氷に変化していくことが分かる。 |
|
|
過冷却が起こる理由は一般的に次のように考えられている。
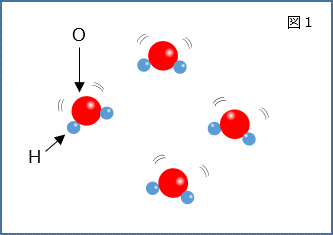
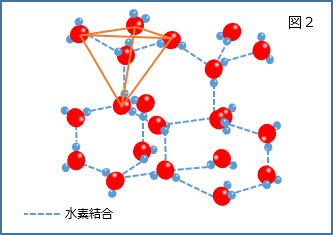
液体(水)の中では図1のように水分子がゆらゆらと熱運動しながら不規則に並んでいるのに対し、固体(氷)は図2のように酸素原子と水素原子が弱い静電気的引力(水素結合)で結びついた規則的な構造をしている。つまり水(液体)が氷(固体)になるためには、不規則な並びから規則的な並びへと変化する必要がある。しかし冷却速度が速い条件下、もしくは結晶核ができない条件下では水分子が乱雑な並びのまま温度が下がっていくため、本来固体になるべき温度になっても液体のまま存在する。これが過冷却の状態である。 |
  |
過冷却の状態からさらに温度が下がっていくと、水分子の熱運動はさらに小さくなっていく。そこに衝撃が加わることなどによって微小な氷の結晶核が生じると、本来固体になるべき温度に達していた水分子が、結晶核めがけて一斉に集まるために急激な結晶化が起こる。その様子が動画1で見られたような「水が氷に変化する現象」である。
それでは液体(水)から過冷却状態を経て固体(氷)に変化するとき、
◎ どのような「温度変化」をするのだろうか。
◎ ミネラル含有率が異なる水では蒸留水と比較してどのような「違い」が見られるだろうか。
今回の熱の実験室ではこの2つの疑問について検証を行ってみたい。 |